进行性斑状色素减少症(Progressive macular hypomelanosis,PMH)由 Guillet 等在 1980 年命名,中文文献中报告的不多,实际上 PMH 并不罕见,但多数皮肤病教科书未纳入本病,因此对它的认识存在不足。
本文简要介绍了 PMH 的发病机制、临床表现、鉴别诊断和治疗手段,并附上了一组典型病例展示,旨在提高读者对本病的认识,从而将其加入色素减退性疾病的鉴别诊断谱。
1. 发病机制
PMH 的发病机制尚不明确。有人认为 PMH 是一种遗传性皮肤病,但并非所有研究均观察到家族聚集性。有人认为 PMH 的色素减退由真菌感染所致,色素改变在感染消失后持续存在,但患者通常无真菌感染史,花斑癣患者愈后也从未观察到继发性 PMH。目前,普遍人认为 PMH 由痤疮丙酸杆菌干扰黑素形成所致,PMH 好发于皮脂溢出部位,这些部位为痤疮丙酸杆菌生长提供了良好的生长条件。
2. 临床表现
PMH 表现为境界不清的圆形或卵圆形色素减退斑,大多对称分布在躯干,有些可进展至颈、面部和四肢近端,在皮脂腺密度高的部位更常见。患者无任何瘙痒、疼痛等不适,也为前驱炎症。
在大多数患者中,可在躯干前、后方观察到斑点融合产生的境界更清晰的色素减退区,融合的面积变异较大,可达 5~20 cm(见图 1)。在躯干侧面可见多少不一的圆形孤立性斑疹,直径约为 0.5~2 cm。
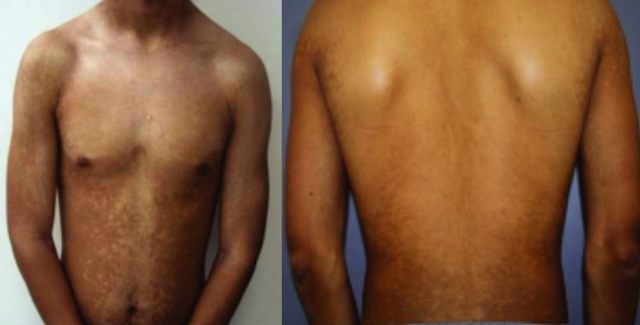
图 1 一例 18 岁男性躯干前、后方的进行性斑状色素减少症,中央的融合区可能与该区域的皮脂腺密度更高有关
色素减退斑在伍德灯检查时更明显,该检查对淡肤色个体尤为有帮助,在色素减退斑点的基础上可观察到毛囊的红色荧光,而在邻近的正常皮肤上则看不到,它是 PMH 的诊断征象之一(见图 2)。

图 2 色素减退斑上毛囊的红色荧光,而邻近的正常皮肤则无荧光
其他实验室检查结果通常为阴性,包括刮取皮屑碘化钾真菌镜检阴性,血液学、尿液分析、抗核抗体、梅毒血清学检查阴性。
3. 组织病理学
PMH 的色素减退斑在组织病理学上仅表现为表皮黑素含量较邻近正常皮肤减少(见图 3),无海绵水肿和湿疹样炎症的其他征象,真皮层无异常。受累皮肤毛囊皮脂腺单位横切面革兰氏染色可见大量革兰氏阳性物质,提示存在痤疮丙酸杆菌(见图 4)。
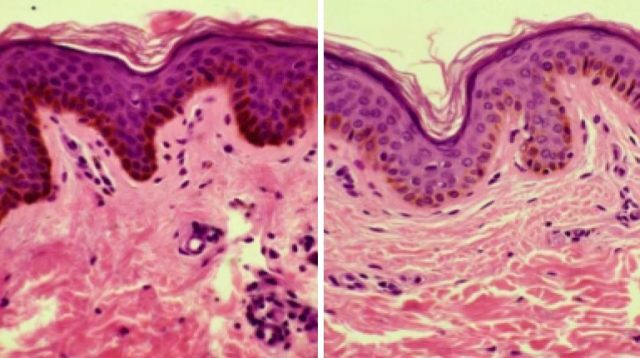
图 3 正常皮肤(左)与皮损区(右)的组织病理学表现,可见皮损区表皮色素减少但真皮正常
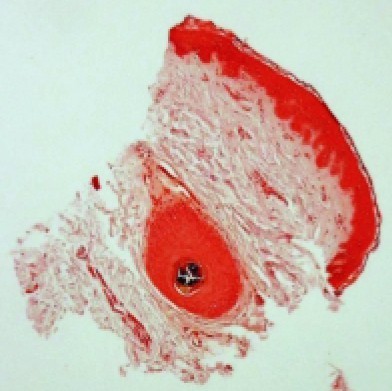
图 4 皮损区毛囊皮脂腺导管中存在革兰氏阳性细菌
近年来,随着共聚焦显微镜技术(也称为皮肤 CT)的发展,为本病提供了一种无创性检查手段,可作为组织病理学检查的替代方法。在共聚焦显微镜下,PMH 皮损处真皮乳头周围的「色素环」完整,但黑素含量与周围正常皮肤相比减少,该结果与组织病理学结果的一致性较高。
4. 鉴别诊断
PMH 应与发生于躯干的其他获得性色素减退相鉴别,这些疾病大体可分为 4 类,即非微生物感染所致的炎症性皮肤病如白色糠疹和炎症后色素减退(例如,异位性皮炎和银屑病);细菌诱发的皮肤病如结核样型或界线类偏结核样型麻风;真菌和酵母菌引起的皮肤病如花斑癣和脂溢性皮炎;以及肿瘤性疾病如蕈样肉芽肿。
这些鉴别诊断的病因各异,需结合临床表现、组织病理学和实验室检查如真菌镜检进行考虑。
5. 治疗选择
在文献报告中,未提及公认的有效治疗,口服或外用抗真菌剂、外用糖皮质激素均未获成功。有人尝试采用 PUVA 疗法获得了暂时性成功,但停止治疗后皮损又恢复到治疗前的水平,该现象可能由于 PUVA 疗法暂时抑制了痤疮丙酸杆菌所致。
有人采用窄谱中波紫外线(NBUVB)治疗 16 例 MMH 患者,其中 9 例(56.2%)显示复色 90% 以上,13 例(81.3%)复色 50% 以上,11 例(68.7%)患者未出现复发迹象,平均随访时间为 13.2 个月。
有人报告 PMH 可在 3~5 年内自发性消失,但其他研究者未发现自发消退趋势,甚至发现皮损在 10~25 年随访期间内持续存在。
6. 典型病例展示
(1)多西环素联合日光浴成功治疗 PMH
患者女,16 岁,躯干皮肤斑点 3~4 年,皮损在夏季更明显,曾被诊断为花斑癣,但外用环吡酮乳膏和吡硫锌香波无效。
体格检查示躯干散在多发性色素减退斑,表面光滑无脱屑,部分融合成斑片,以乳房、背部中央和腰围最明显(见图 5)。
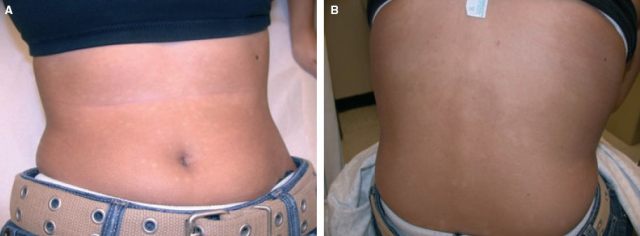
图 5 腹部(A)和背部(B)多发性色素减退性斑疹,融合成斑片
考虑的鉴别诊断包括花斑癣后炎症性色素减退、白色糠疹和色素减退性皮肤 T 细胞淋巴瘤。在背部中央皮损处进行了环钻活检,显示散在的浅血管周围淋巴细胞浸润和轻度色素失禁,符合炎症性色素减退,但无花斑癣、副银屑病、苔藓样糠疹或淋巴瘤的证据。
最初给予患者地奈德溶液治疗,腹部皮损显著改善,并且经夏季日晒后进一步消退,但 6 个月后色素减退斑再次融合成更广泛的斑片,累及躯干和腋窝。因此,将诊断修正为 PMH,患者间断口服多西环素治疗 6 周,并进行日光浴,皮损几乎完全消退。
(2)NBUVB 成功治疗 PMH
患者女,13 岁,躯干部无症状性色素减退斑 1 年。体格检查见躯干和四肢近端散在较多圆形色素减退性斑疹,周围有细碎脱屑(见图 6)。最初考虑花斑癣,但皮屑真菌镜检阴性,伍德灯检查见微弱的红色毛囊性荧光。考虑为 PMH,活检组织病理学检查示表皮无改变,基底层黑素数量正常,真皮轻度炎细胞浸润,符合 PMH。
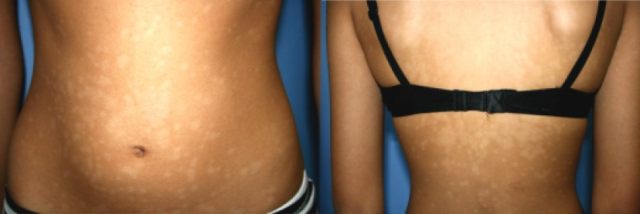
图 6 躯干部位泛发性色素减退性斑点,圆形或卵圆形
最初给予患者 1% 克林霉素和 5% 过氧化苯甲酰外用治疗 2 个月,皮损无消退并有新发疹出现。遂改用 NBUVB 光疗(初始剂量 0.2 J/cm2),每周 3 次,最大剂量为 1.2 J/cm2,治疗 25 次(累积剂量 18 J/cm2)后皮损完全消退,7 个月随访时仅少数几处皮损复发。
(3)异维 A 酸治疗 PMH 有效
患者,男,35 岁,躯干部多发性无症状性斑疹和斑片 10 年。患者无前驱炎症性皮肤病史。患者曾被诊断为花斑癣而接受抗真菌乳膏治疗,但无效果。体格检查见患者躯干散在光滑的色素减退斑,部分融合成斑片,所有皮损表面均无鳞屑(见图 7)。
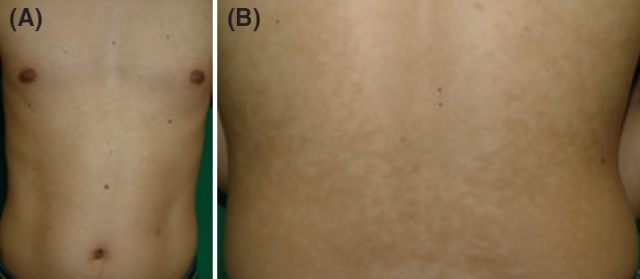
图 7 躯干多发性色素减退性斑,部分融合成斑片
刮取皮屑行真菌镜检结果为阴性。色素减退斑处伍德灯检查见红色毛囊性荧光,但邻近的正常皮肤无荧光。对色素减退斑点及邻近正常皮肤实施了环钻活检,组织病理学仅显示表皮黑素减少,Melan-A 染色未发现黑素细胞数量存在任何差异。
给予患者 NBUVB 光疗(起始剂量为 0.2 J/cm2,每周两次),治疗 3 个月后皮损无改善,此时患者由于面部酒渣鼻开始服用异维 A 酸 10 mg/d,1 月后随访时,观察到患者的 PMH 损害显著消退,患者自行停药。停药后 10 个月随访时,躯干皮疹未复发。
(4)NBUVB 治疗 PMH 获部分性疗效
患者女,27 岁,全身多发性色素减退斑 2 个月,皮损最初出现在胸部,数量和大小不断增加,逐渐扩展至全身,患者在发疹前曾受到阳光暴晒,并由于人免疫缺陷病毒(HIV)暴露而接受过司他夫定、拉米夫定和洛匹那韦预防治疗 30 天。她未发生过其他感染,也未服用其他药物。
体格检查示全身对称性散在分布的钱币状色素减退斑,部分融合,斑疹表面无脱屑,以躯干、后背和四肢为著。皮损边界清晰,无炎症征象(见图 8)。
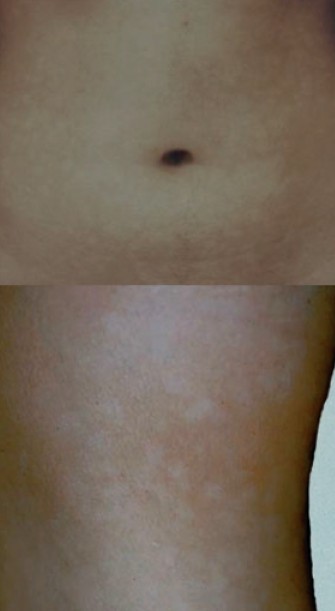
图 8 全身多发性色素减退性斑片,无脱屑,以躯干部为著
反复行真菌镜检和培养结果均为阴性。皮损活检组织病理学示表皮基底层黑素细胞数量减少,其他无明显异常。结合临床和实验室检查诊断为 PMH。给予患者 NBUVB 治疗 10 周后中等程度复色,随访 6 个月未出现新发疹。
(5)过氧化苯甲酰联合 NBUVB 治疗 PMH 有效
患者女,24 岁,躯干无症状性色素减退斑 18 个月。患者曾被诊断为花斑癣,接受联苯苄唑治疗无效。
体格检查示躯干部境界清楚的多发性色素减退斑,直径 1.5 cm,表面无鳞屑(见图 9)。皮损在伍德灯下更明显,可见红色毛囊性荧光。皮损环钻活检组织病理学检查示表皮黑素细胞减少,淋巴细胞浸润极少。根据临床和组织病理学改变诊断为 PMH。
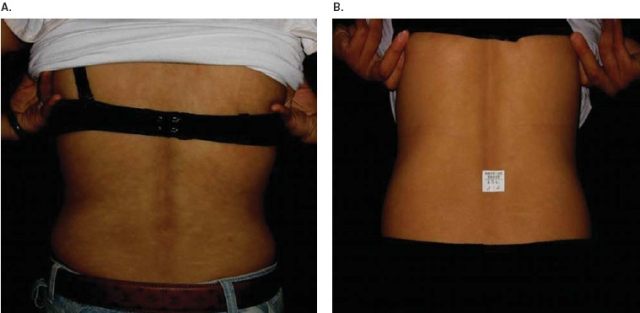
图 9 背部多发性境界清楚的 1.5 cm 大小圆形至卵圆形色素减退性斑疹或斑片(A);仅过氧化苯甲酰和 UBUVB 治疗后皮损消退(B)
给予患者 5% 过氧化苯甲酰外用 2 周,皮损略有改善,伍德灯下红色毛囊性荧光消失。然后给予 NBUVB(起始剂量为 0.5 J/cm2,每次递增 20%)治疗,每周 2 次,共 12 次,观察到皮损显著消退。
(6)不对称分布的 PMH
患者女,28 岁,背部无症状性白斑 3 年,皮疹最初出现于左上背部,缓慢扩展至左上肢,但大小保持稳定。在怀孕后病情发展速度明显加快。患者曾被诊断为花斑癣,并接受了环吡酮乳膏和吡硫锌香波治疗但无改善。
体格检查见散在境界清楚的圆形或卵圆形斑疹,无炎症征象,在左上背部和左上肢不对称分布,身体右侧无皮疹(见图 10)。

图 10 背部色素减减退性斑疹
反复真菌镜检和培养阴性。组织病理学示基底层黑素含量减少,真皮浅层轻度淋巴细胞浸润。共聚焦显微镜检查也显示皮损区黑素含量较邻近正常皮肤减少(见图 11)。结合临床和病理学改变,诊断为 PMH。
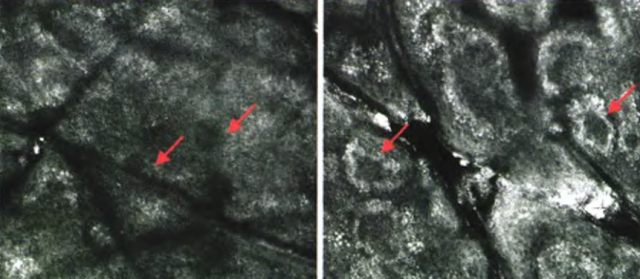
图 11 皮损区(左)黑素含量与正常皮肤(右)相比减少
综上所述,PMH 的皮疹很容易被误诊为花斑癣,但真菌学检查可资鉴别。除了基底层黑素含量减少外,本病在组织病理学上无特殊改变,如果临床怀疑本病,共聚焦显微镜是一种无创的替代性确证检查手段。在治疗方面,可考虑采用针对痤疮丙酸杆菌的药物联合 NBUVB 治疗。
参考文献
[1] Relyveld GN, Menke HE, Westerhof W. Am J Clin Dermatol, 2007, 8(1):13-19.
[2] Kim MB, Kim GW, Cho HH, et al. Narrowband UVB treatment of progressive macular hypomelanosis. J Am Acad Dermatol, 2012,66(4):598-605.
[3] Perman M, Sheth P, Lucky AW. Progressive macular hypomelanosis in a 16-year old. Pediatr Dermatol, 2008, 25(1):63-65.
[4] Montero LC, Belinchón I, Toledo F, et al. Progressive macular hypomelanosis, excellent response with narrow-band ultraviolet B phototherapy. Photodermatol Photoimmunol Photomed, 2011, 27(3):162-163.
[5] Kim YJ, Lee DY, Lee JY, et al. Progressive macular hypomelanosis showing excellent response to oral isotretinoin. J Dermatol, 2012, 39(11):937-938.
[6] Lo Schiavo A, Gambardella A, Caccavale S. The possible role of antiretroviral drugs in the pathogenesis of progressive macular hypomelanosis. Int J Dermatol, 2014, 53(6):759-760.
[7] Wu XG, Xu AE, Luo XY, et al. A case of progressive macular hypomelanosis successfully treated with benzoyl peroxide plus narrow-band UVB. J Dermatolog Treat, 2010, 21(6):367-368.
[8] Neynaber S, Kirschner C, Kamann S, et al. Progressive macular hypomelanosis: a rarely diagnosed hypopigmentation in Caucasians. Dermatol Res Pract, 2009, 2009:607682.
[9] Wen LL, Wang T, Yang C, et al. Progressive macular hypomelanosis with asymmetrically distributed lesions. Chin Med J (Engl), 2013, 126(18):3591.
