协和发酵麒麟(中国)制药有限公司近日宣布,布罗利尤单抗(商品名:立美芙 ®)获得国家药品监督管理局批准,用于适合系统治疗或光疗的成人中至重度斑块状银屑病。此次加速审批,是由于 2018 年国家药品监督管理局药品审评中心把布罗利尤单抗纳入《第一批临床急需境外新药名单》。

中华医学会皮肤性病学分会第 13 届主任委员,北京大学人民医院皮肤科主任张建中教授表示:布罗利尤单抗的在华获批,标志着全球现有的白介素-17 抑制剂已悉数进入中国,将为中国银屑病的治疗带来新的选择,是中国银屑病患者的福音!

中华医学会银屑病专业委员会主委兼首席专家,复旦大学皮肤病研究所所长张学军教授表示:布罗利尤单抗是国内首个白介素 17 受体 A 的抑制剂,其独特的作用机制也为中国银屑病的治疗带来了新的选择。希望其积累更多的中国临床数据和应用经验,更好的指导临床治疗。
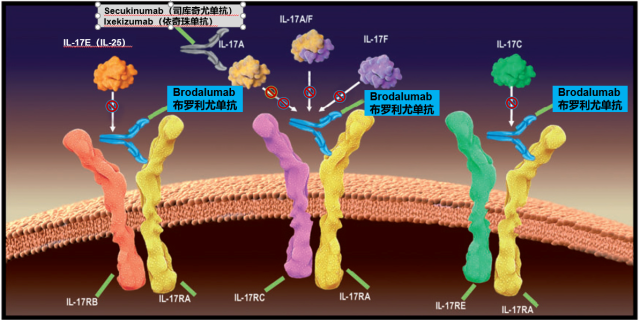
布罗利尤单抗是目前国内首个以白介素 17 受体 A 为靶点的全人源化单克隆抗体。白介素 17 家族包括白介素 17A,17B,17C,17D,17E,17F, 有研究表明白介素 17A 在银屑病的发病机制中发挥核心作用 [1],白介素 17C,17F,17E 同样也发挥致病作用 [2-4]。而白介素 17 受体 A 是白介素 17A, 17C,17F,17E 共同的受体亚单位 [5],布罗利尤单抗通过抑制白介素 17 受体 A,不仅能够抑制白介素 17A,而且还能抑制白介素 17C,17F,17E[6]。为了清除皮损,可谓是「火力全开」。其独特的作用机制,可能带来更多的临床获益 [7-8]。
AMAGINE-2 是布罗利尤单抗的三期临床试验之一 [9],它纳入欧美地区 142 个临床中心的 1831 名患者,布罗利尤单抗 210 mg 组 12 周有 42% 的患者达到皮损完全清除(PASI100),52 周有 56% 的患者达到 PASI100。而在日本的临床试验中,布罗利尤单抗 210 mg 组在 12 周和 52 周的 PASI100 分别达到 59.5% 和 63.9%[10-11]。
布罗利尤单抗被批准用于适合系统治疗或光疗的成人中至重度斑块状银屑病。本品须由在斑块状银屑病的诊断和治疗方面有经验的医生指导和监督下使用。本品为预充式注射器,应皮下注射给药,推荐剂量为每次 210 mg。初始给药为成人在首次、第 1 周、第 2 周皮下给予 210 mg,此后每 2 周 1 次皮下给药。

协和发酵麒麟(中国)制药有限公司总经理参川和伸先生表示:我非常高兴布罗利尤单抗能在中国获批,中国有超过 600 万的银屑病患者,对于中重度患者而言,疾病严重的影响着他们的身心健康。布罗利尤单抗是一种有着独特作用机制的白介素 17 类生物制剂,必将为解除中国广大银屑病患者的病痛做出自己的贡献。
目前,布罗利尤单抗已在欧盟,美国和日本在内的多个国家和地区上市,惠及全球众多患者。
参考文献:
1. Kopf M et al. Averting inflammation by targeting the cytokine environment. Nat Rev Drug Discov. 2010;;9(9):703-18
2. Andrew Johnston,et,al. J Immunol 2013; 190:2252-2262
3. Hideaki Watanabe,et al. Journal of Investigative Dermatology (2009) 129, 650–656
4. Miao Xu, et al. An Interleukin-25-Mediated Autoregulatory Circuit in Keratinocytes Plays a Pivotal Role in Psoriatic Skin Inflammation. Immunity 2018.48, 787–798
5. David A. Martin,et al. Journal of Investigative Dermatology.2013(133):17-26
6. Kristen M. Brodalumab for the treatment of plaque psoriasis: up-to-date. EXPERT OPINION ON BIOLOGICAL THERAPY. 2019, 19(4): 287-292
7. Nicolo Costantino Brembilla,et,al. The IL-17 Family of Cytokines in Psoriasis:IL-17A and Beyond.Front Immunol. 2018 Aug 2;9:1682. doi:10.3389/fimmu.2018.01682
8. Jason E. Hawkes, et al.Journal of Immunology, 2018, 201: 1605–1613.
9. M. Lebwohl,et al. Phase 3 Studies Comparing Brodalumab with Ustekinumab in Psoriasis. N Engl J Med 2015;373:1318-28
10. Hidemi Nakagawa,et al. Brodalumab, a human anti-interleukin-17-receptor antibody in the treatment of Japanese patients with moderate-to-severe plaque psoriasis: Efficacy and safety results from a phase II randomized controlled study.J Dermatol Sci. 2016 Jan;81(1):44-52
11. Umezawa Y, et al. Clinical Efficacy and Safety of Brodalumab (KHK4827),Anti-interleukin-17-Receptor A Fully Human Monoclonal Antibody, in Japanese Patients with Moderate to Severe Plaque Psoriasis: An Open-Label Extension (OLE) Study (4827-003 Study). Poster presented at: European Academy of Dermatology and Venereology; 2016 Sep 28-Oct 02; Austria
